Применение флэш-хроматографических систем SepaBean с колонками SepaFlash в фармацевтике
Очистка низкомолекулярных пептидов с помощью картриджей SepaFlash серии HP Bio
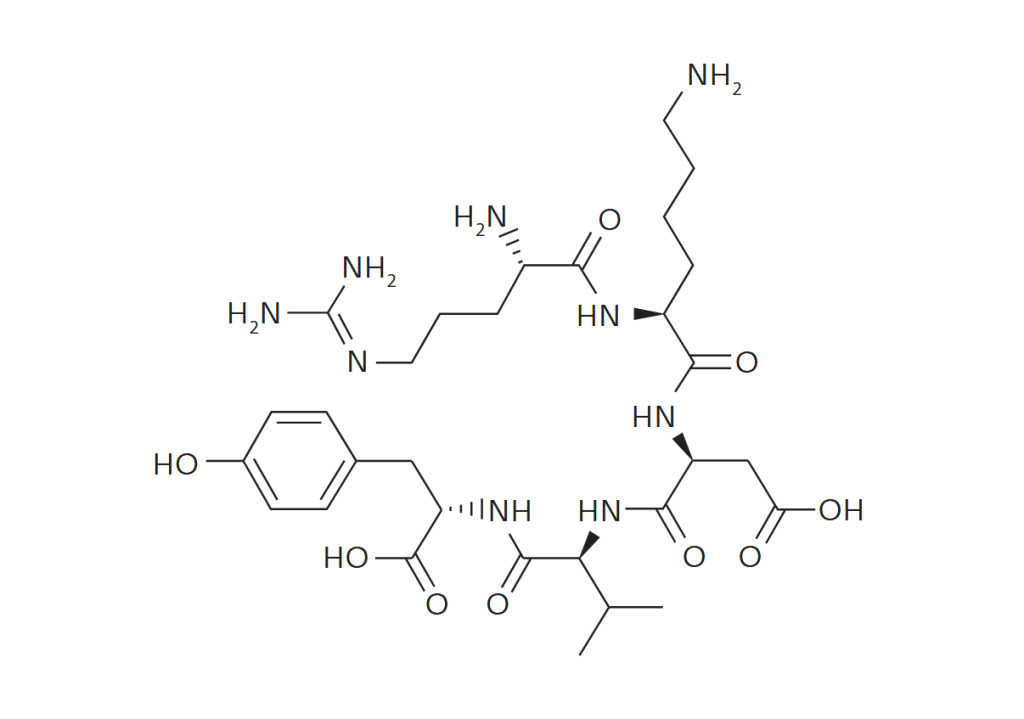
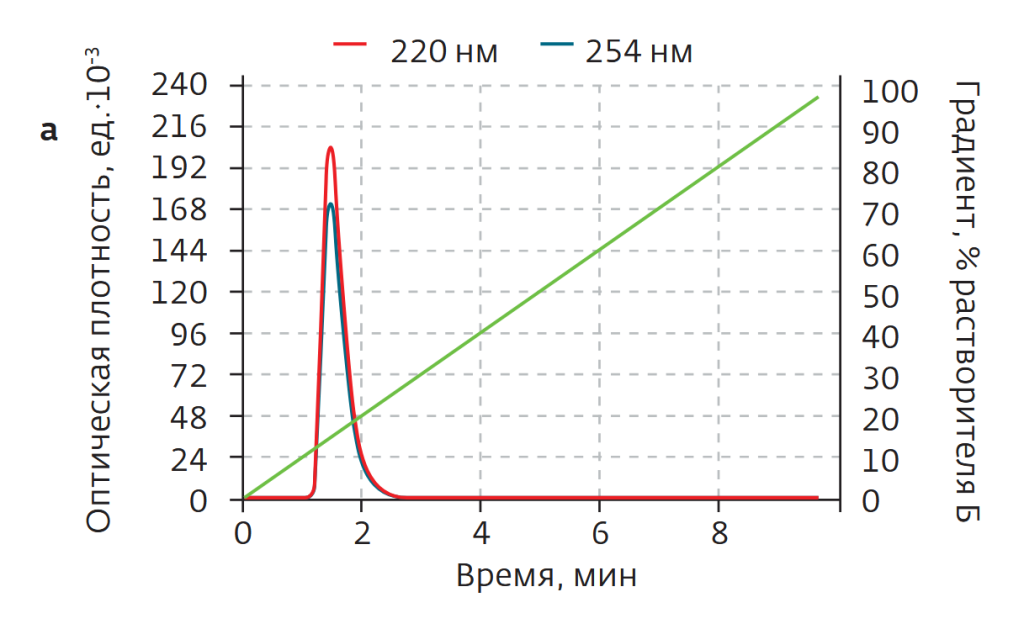
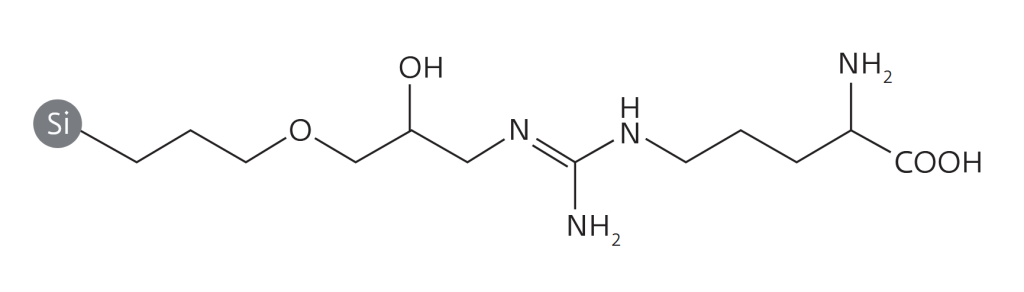
С развитием биотехнологий и технологий синтеза пептидов ширится производство и применение пептидных фармакологических препаратов. При твердофазном синтезе таких соединений в условиях массового производства необходимы методы надежной очистки. Традиционно для этого применяли ионообменную и обращенно-фазовую ВЭЖХ. Однако методы, замечательные для аналитических задач, обладают низкой производительностью (малый допустимый объем загрузки образцов), высокой стоимостью сорбентов, оборудования и пр. Флэш-хроматографические решения Santai Technologies позволяют избавиться от подобных недостатков, обеспечивая высокую чистоту (>94%) готового продукта. Это показали авторы работы[1] на примере очистки образца тимопентина – синтетического пентапептида с аминокислотной последовательностью Arg-Lys-Asp-Val-Tyr, с брутто-формулой C30H49N9O9 и молекулярной массой 679,41 Да. В работе использовался образец типа TP-5 с аминокислотными остатками тимозина II в позициях 32–36 (рис.1). Данный препарат является иммуномодулятором, используемым в клинической практике с 1980-х годов, в частности для больным СПИДом. Для очистки препарата использовались 12-граммовый картридж SepaFlash HP Bio с привитой фазой C18, сферические частицы силикагеля диаметром 15 мкм с порами 100 Å. Чистота исходного материала и очищенного образца контролировалась с помощью ВЭЖХ-системы Agilent 1100 c аналитической колонкой С18 (4,6 × 150 мм, размер частиц 5 мкм). Исходный материал содержал 80,5% ТР-5 (рис.2).
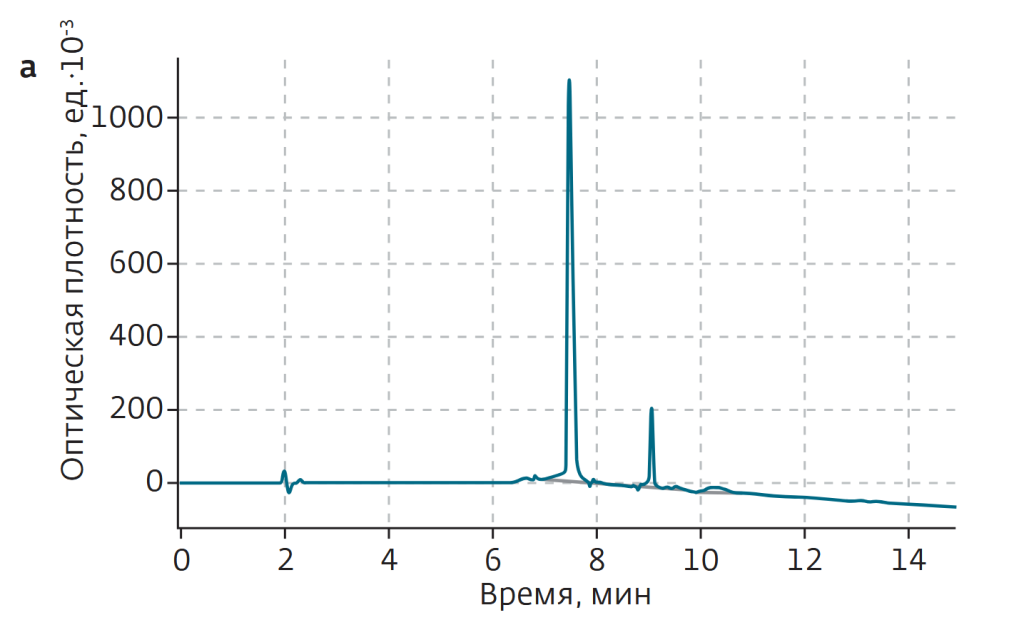
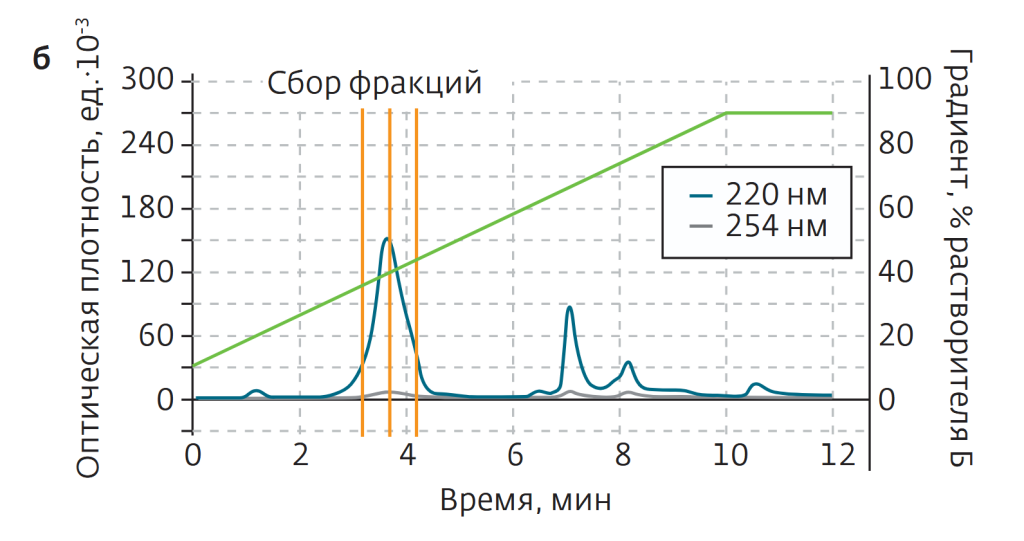
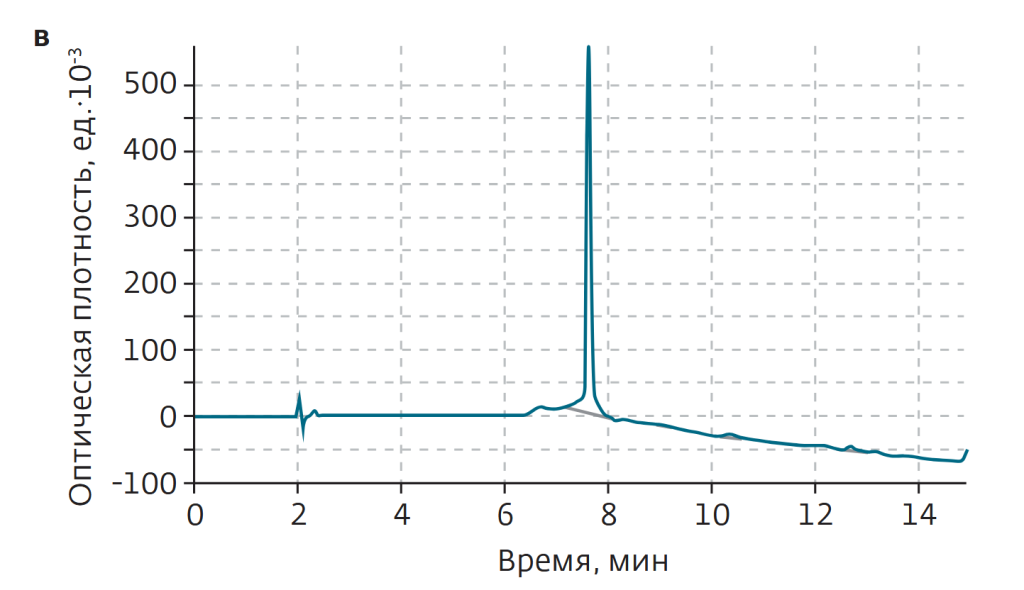
В процессе очистки 45 мг исходного материала ТР-5 растворяли в 1 мл раствора метанола в воде (V:V=3:7), после чего вводили во флэш-картридж. Растворителями служили вода (а) и метанол (б). Градиент метанола — линейный, от 10% изначально до 90% к минуте 10 (рис.2б). Очистка проводилась в один проход. После лиофильной сушки масса образца составила 27,5 мг, а определенная посредством ВЭЖХ чистота — 94,1%.
Очистка сильно полярных пептидов
Мы рассмотрели пример очистки достаточно низкомолекулярного неполярного пептида. Но как быть, если необходимо разделение пептидов с высокой степенью полярности, имеющих в составе остатки полярных аминокислот, таких как цистеин, глутамин, аспарагин, серин, треонин, тирозин и т.п.?
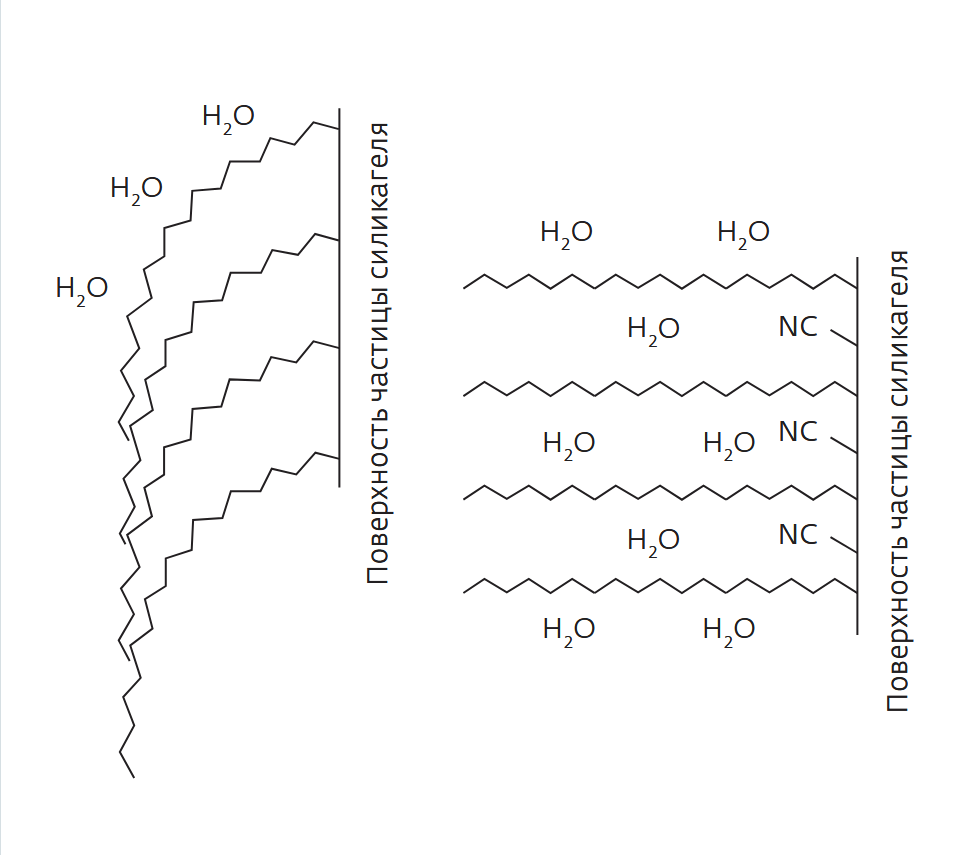
Традиционный метод разделения таких соединений — обращенно-фазовая хроматография с силикагелем с привитым октадецилсиланом (С18). Однако на сорбентах С18 по мере увеличения полярности образцов время их удерживания на неподвижной фазе уменьшается, поскольку неподвижная фаза неполярна. Для компенсации этого эффекта обычно увеличивают долю полярного растворителя, т.е. воды или водных солевых растворов. Проблема в том, что по мере увеличения концентрации воды возрастает опасность так называемого гидрофобного коллапса. Суть этого явления – длинные хвосты октадецилсилана (в случае С18), привитые на частицы силикагеля, в силу их гидрофобности отталкивают молекулы воды, начинают взаимодействовать друг с другом — как бы слипаются (рис.3). В результате взаимодействие с полярной подвижной фазой снижается в еще большей мере, компоненты образца практически перестают удерживаться. Причем зачастую повреждения колонки необратимы, даже если ее промыть органическими растворителями.
Для предотвращения гидрофобного коллапса разработаны специальные сорбенты. Например, поверхность частиц силикагеля С18 модифицируют гидрофильными нитрильными группами (CN). Такие колонки обозначают как С18AQ (от aqueous — водные), они радикально решают проблему работы с сильнополярной подвижной фазой. В работе[2] описан сравнительный анализ колонок с сорбентами С18 и С18AQ при очистке полярного пептида с молекулярной массой порядка 1 кДа. В эксперименте использовалась установка SepaBean machine 2 и одинаковые 12-граммовые картриджи SepaFlash серии HP bonded. Они различались только сорбентом. В одной был стандартный С18 со сферическими частицами силикагеля диаметром 20–45 мкм и порами 100 Å. В другом картридже использовался аналогичный по размеру частиц сорбент С18AQ, модифицированный для водных растворов.
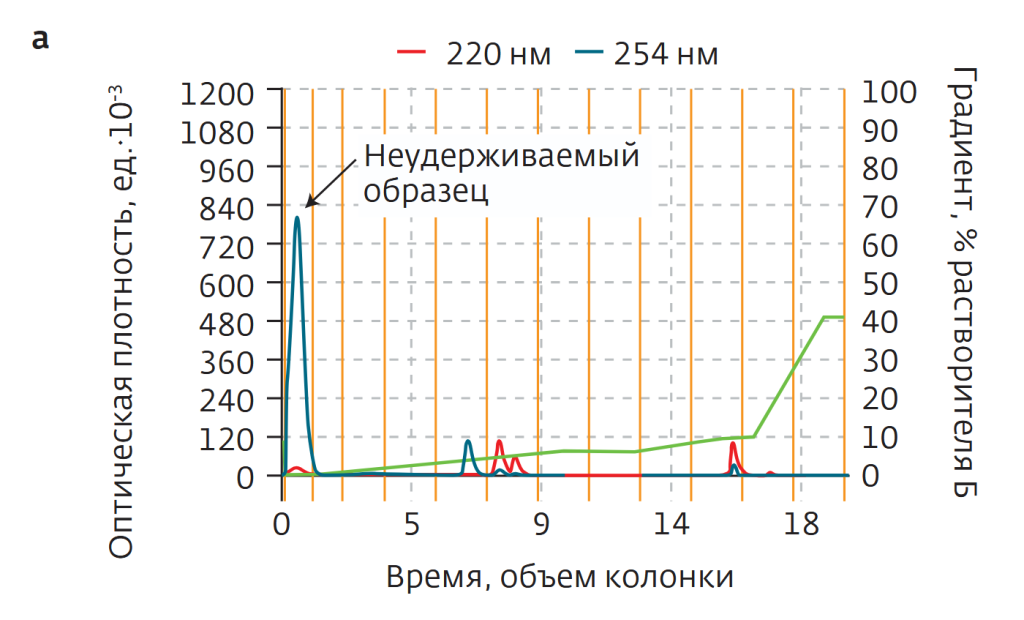
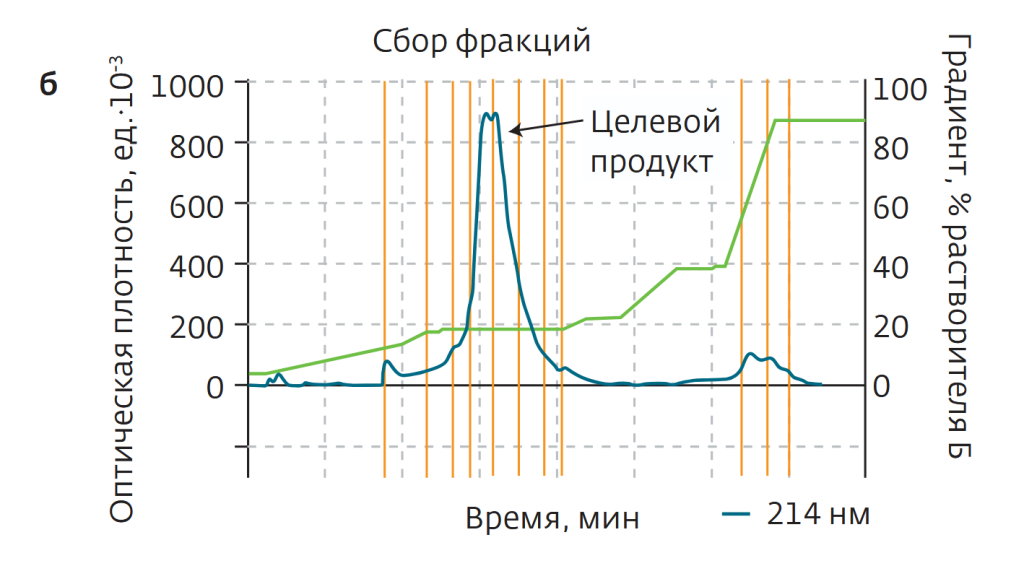
Чистота исходного образца составляла 80%. 60 мг образца растворили в 5 мл чистой воды. При разделении в качестве растворителей использовалась чистая вода (а) и ацетонитрил (б). Образец, разделенный на две равные части, загружался в колонки и подвергался разделению при ступенчатом градиенте ацетонитрила. В результате образец не удерживался на колонке С18 (рис.4а), практически полностью вымываясь с растворителем в самом начале процесса. Напротив, в случае колонки С18AQ пептид эффективно удерживался в колонке (рис.4б). После лиофильной сушки чистота образца составила 98,2%.
Очистка сильнополярных тиазидных соединений посредством SepaFlash HILIC ARG
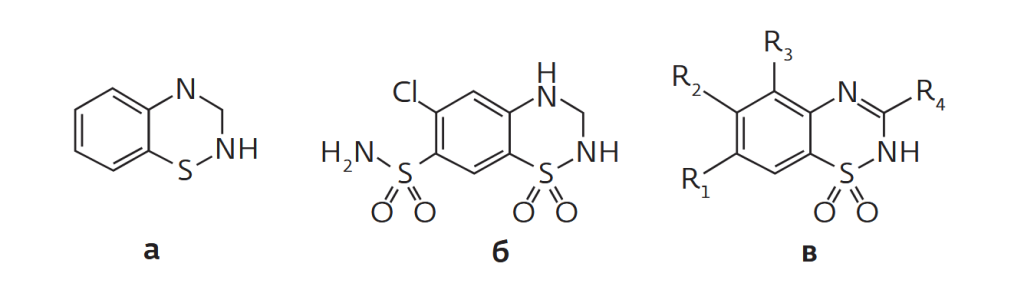
Тиазиды — гетероцикилические соединения, содержащие азот и серу. На их основе, прежде всего бензотиадизина, производится целый класс диуретиков, например гидрохлоротиазид (рис.5).
Для очистки таких препаратов в компании Santai Technologies разработан специальный флэш-картридж SepaFlash HILIC ARG, в которой к сферическим частицам силикагеля привиты группы аргинина (см.рис.5). Авторы работы[3] провели сравнительный анализ очистки образца производной бензотиадизина посредством традиционных колонок SepaFlash С18 и SepaFlash HILIC ARG.
Исследуемый образец (рис.5в) представлял собой полярное основное соединение, малорастворимое в большинстве растворителей, включая метанол, воду и др. По данным ВЭЖХ, чистота исходного образца составляла около 81%. Стандартный в таких случаях подход заключается в применении обращенно-фазовой хроматографии с колонками С18. Чтобы повысить растворимость, в воду добавили небольшое количество трифторуксусной кислоты (CF3COOH) для образования растворимой соли. Полученный раствор вводили в картриджи для последующего разделения на установке SepaBean machine T. В процессе очистки использовалась смесь двух растворителей – воды (А) и ацетонитрила (Б), в каждый из которых добавляли 0,1% CF3COOH.
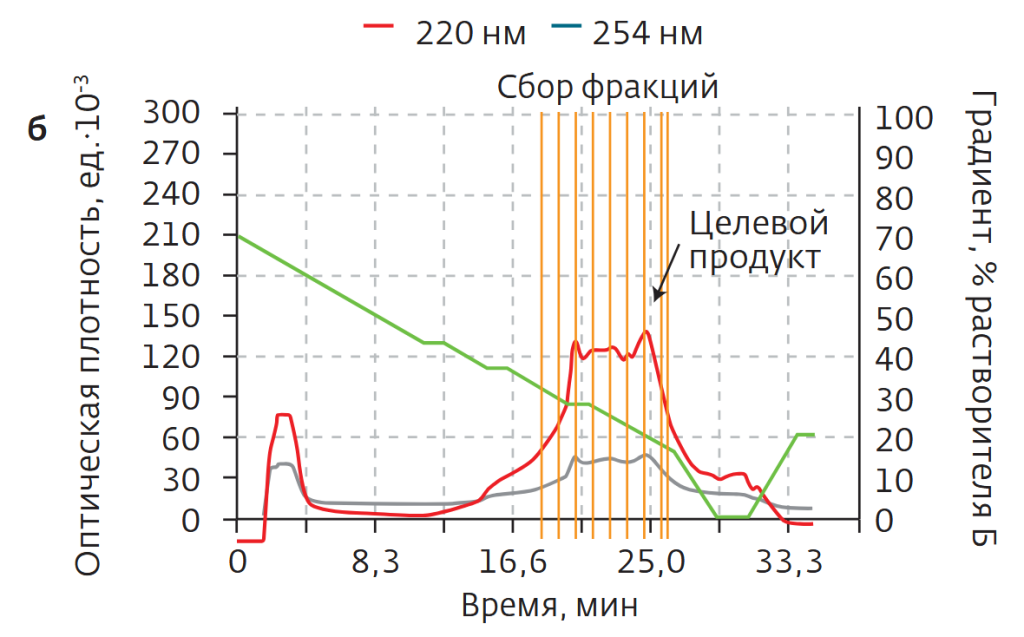
В первом случае раствор вводился в 12-граммовый картридж SepaFlash HP Bonded со сферическими частицами силикагеля (диаметр 20–45 мкм, поры 100 Å). Градиент — линейный, концентрация ацетонитрила в течение 10 мин возрастала от 10 до 90% (рис.6а). Скорость элюирования — 15 мл/мин, масса загруженного образца — 100 мг. Как видно из рис.16а, удерживание образца на сорбенте С18 было низким, благодаря высокой полярности смесь легко вымывалась из колонки в составе элюента, без качественного разделения.
Другой подход заключался в применении метода гидрофильной хроматографии (HILIC — hydrophilic interaction liquid chromatography)[4], который сочетает полярные подвижные фазы, характерные для обращенно-фазовой ЖХ, с неподвижными фазами, характерными для нормально-фазовой хроматографии. Для эксперимента использовался картридж SepaFlash HILIC ARG, в точности аналогичный картриджу С18, но с привитыми группами аргинина (рис.7) В отличие от первого эксперимента, концентрация воды возрастала — от 30% в начале процесса до 100% к 35-й минуте (рис.7б). Масса загруженного образца составляла 500 мг, скорость элюирования — 50 мл/мин. Как видно из рис.17б, удерживание на сорбенте с привитыми остатками аргинина существенно выше, что обеспечило эффективное разделение. После лиофильной сушки полученных фракций, по данным ВЭЖХ, чистота продукта составила 95,3%.
Ортогональная очистка синтетических промежуточных фармацевтических субстанций
В отдельных случаях сложные смеси тяжело разделить каким-либо одним способом. Тогда на помощь приходят сочетания методов разделения на основе различных (ортогональных) механизмов. Например, последовательное разделение на нормально- и обращенно-фазовых колонках. Такой подход при разделении промежуточного фармацевтического продукта описан в работе[5].
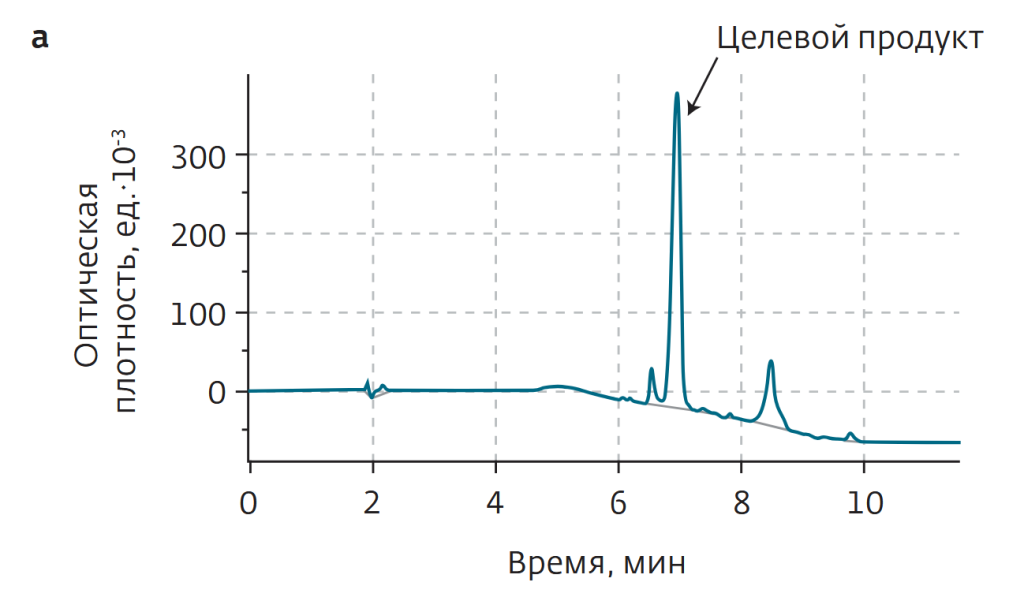
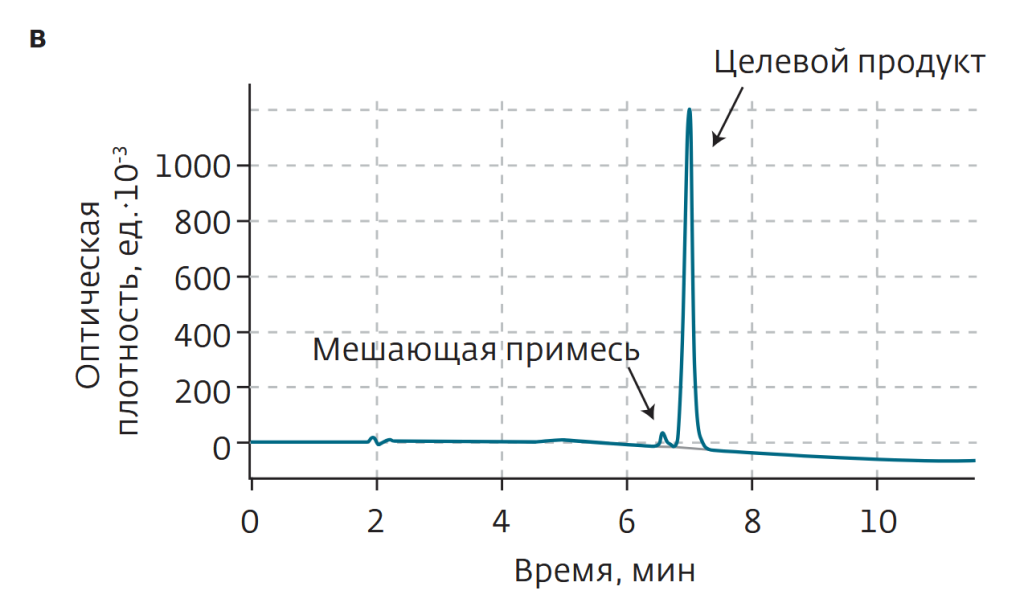
Образец изначально был растворен в малом количестве метанола и проанализирован посредством ВЭЖХ. Концентрация целевого компонента в смеси составила 66% (рис.8а). Причем время удержания одной из мешающих примесей было близко к времени удержания целевого соединения, что и определяло основную сложность разделения.
На первом этапе использовался метод нормальнофазовой ЖХ. Сначала 3 г образца растворили в метаноле и абсорбировали на 6 г силикагеля того же типа, что и в картридже, — с нерегулярными частицами размером 40–63 мкм и порами 100 Å. После чего органический растворитель был удален в роторном испарителе, а полученный образец загружен в пустой картридж серии iLOK (метод сухой загрузки).
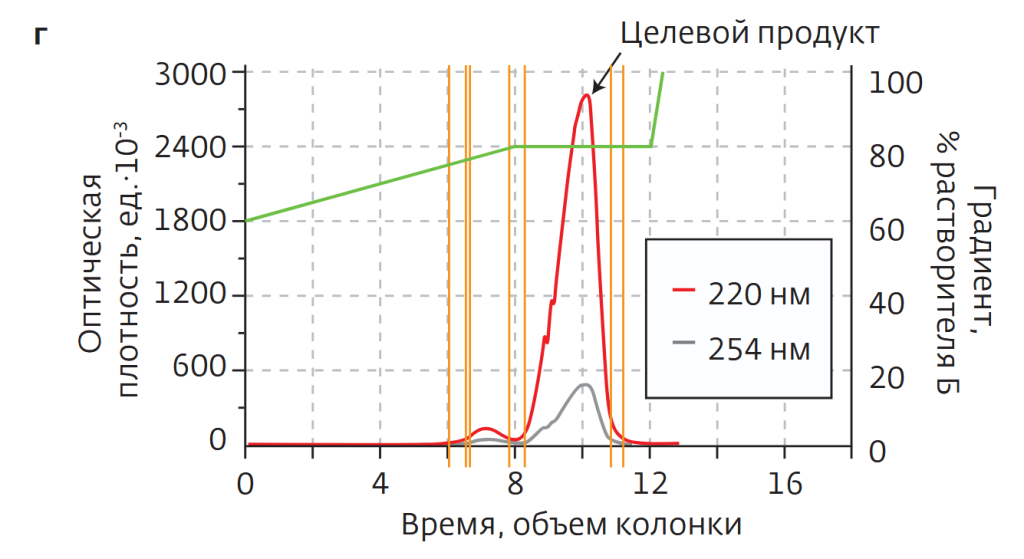
Разделение проводилось на установке SepaBean machine T, картридж — 80-граммовый SepaFlash серии Standard Series, растворитель – этилацетат, скорость элюирования — 50 мл/мин, изократический градиент (рис.8б).
ВЭЖХ-анализ собранной после разделения фракции показал содержание целевого продукта на уровне 92% (рис.8в), что не удовлетворяло производственным требованиям (не ниже 95%). Главным образом мешали примеси с близким временем удерживания при нормально-фазовой хроматографии.
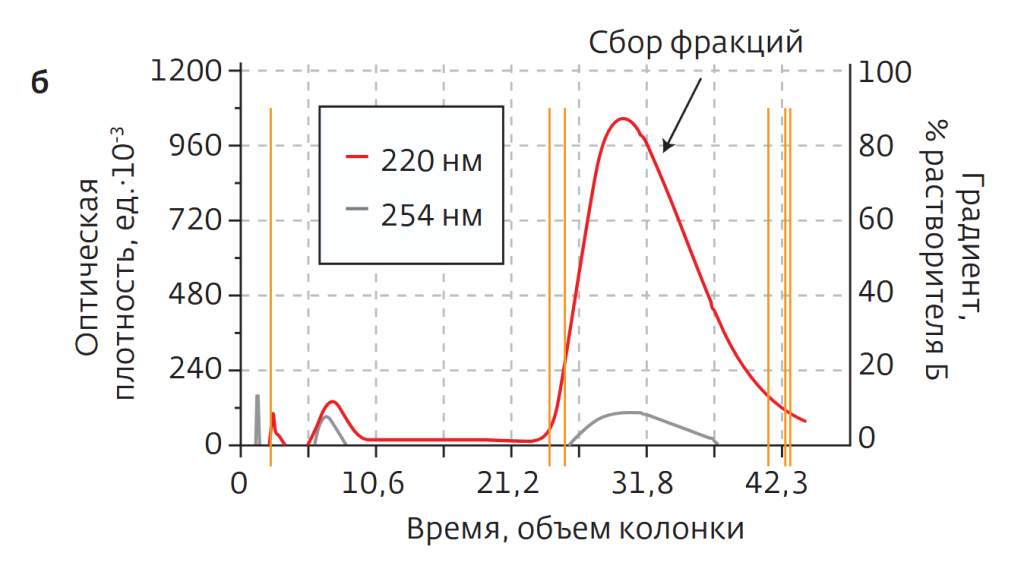
На втором этапе из собранной на первом этапе фракции удалили остатки растворителя на роторном испарителе. Затем 300 мг образца растворили в 2,5 мл метанола с добавкой нескольких капель диметилсульфоксида. Затем жидкий образец ввели в 120-граммовый картридж С18 (SepaFlash HP Bonded со сферическими частицами силикагеля, привитыми С18, диаметр 20–45 мкм, поры 100 Å) и провели разделение при скорости элюирования 30 мл/мин. Растворители — вода (а) и метанол (б). Концентрация метанола в процессе разделения линейно изменялась от 60 до 80% за время элюирования 8 объемов колонки, затем оставалась неизменной, в конце процесса увеличилась до 100% (рис.18г). В результате концентра ция целевого продукта в собранной фракции составила порядка 98%.
Продукты компании Santai Technologies в области препаративной флэш-хроматографии позволяют решать актуальные задачи получения чистых субстанций в современной фармацевтике, при тонком органическом синтезе и во множестве других областей.
Литература
- Wenjun Qiu, Meiyuan Qian, Bo Xu. The Putification ofSmall Molecule Peptide by SepaFlash HP Bio Series FlashCartridge // Santai Technologies, Chromatography Appli-cation Note AN 006.
- Rui Huang, Bo Xu. The Application of C18AQ Columnsin the Purification of Strong Polar Peptides // SantaiTechnologies, Chromatography Application NoteAN 018.
- Run Xiao, Rui Huang, Bo Xu. The Application of SepaFlashHILIC ARG Cartridge for the Purification of Strong PolarThiazide Compound // Santai Technologies, Chromatog-raphy Application Note AN 026.
- Чернобровкина А.В., Смоленков А.Д., Шпигун О.А.Гидрофильная хроматография – перспективный ме-тод определения полярных веществ // Лабораторияи производство. 2018. № 4. С. 76–92.
- Meiyuan Qian, Bo Xu. The Application of OrthogonalChromatography for the Purification of Synthetic Phar-maceutical Intermediates // Santai Technologies, Chro-matography Application Note AN024.




